 Bucephalandra: viele neue Arten?
Bucephalandra: viele neue Arten?
Dieser Artikel wurde von Heiko Muth am 26.02.2014 im Flowgrow Aquascaping Network veröffentlicht. Zu diesem Zeitpunkt wurden noch fünf Bucephalandra-Arten unterschieden. In der Zwischenzeit ist die Anzahl wissenschaftlich beschriebener Arten auf 31 angewachsen (Stand Januar 2020).
Im Aquarienhobby kennt man mittlerweile unzählige Bucephalandra-Formen in faszinierender Vielfalt. Die Botaniker kennen die Vielgestaltigkeit der vor über 150 Jahren beschriebenen Gattung schon länger als die Hobbyisten, dennoch unterscheiden sie momentan nur wenige Arten. Hier möchte ich ziemlich ausführlich darüber informieren, was bisher über diese Pflanzen von wissenschaftlicher Seite bekannt ist.
Allgemeines und Geschichtliches
Die Pflanzen aus der Gattung Bucephalandra sind auf Borneo endemisch und auf dieser Insel weit verbreitet: in Sarawak (= Ost-Malaysia), Kalimantan (indonesischer Teil von Borneo) und im Sultanat Brunei. Die Art B. gigantea wurde auf 700 m Höhe über dem Meer gefunden, die Fundorte der anderen Bucephalandra-Pflanzen liegen meistens in einer Meereshöhe von 350 m oder weniger, vereinzelt auch bis 500 m und in einem Fall in 1200 m Höhe (Bogner & Hay 2000). Bucephalandra wächst als Rheophyt (dazu weiter unten mehr) an und in felsigen Urwaldbächen und –flüssen auf Gestein.
Diese Gattung wird zu den Aronstabgewächsen (Araceae) gezählt. Innerhalb dieser Familie gehört sie zur Unterfamilie Aroideae und zur Tribus Schismatoglottideae (die Tribus ist eine taxonomische Rangstufe zwischen Unterfamilie und Gattung), auch dazu weiter unten Ausführliches. Auf Borneo gibt es auch Pflanzen aus anderen Gattungen, die äußerlich Bucephalandra-Arten sehr ähneln.

Im Jahr 1858 stellte Heinrich Wilhelm Schott die Gattung Bucephalandra auf und beschrieb die erste Art, B. motleyana, nach einer Pflanze aus Süd-Kalimantan. Odoardo Beccari entdeckte später in Sarawak eine sehr kleine Pflanze und beschrieb sie 1879 als neue Gattung Microcasia (mit der Art M. pygmaea), weil bestimmte Details der Blütenstände deutliche Unterschiede zu Schotts Beschreibung und Abbildung von Bucephalandra zeigten. Josef Bogner fand 1980 heraus, dass die Blütenstands-Merkmale, mit denen Beccari seine neue Gattung Microcasia begründete, in Wirklichkeit auch am Typus-Herbarbeleg (im Kew Herbarium) von B. motleyana zu finden sind. Schott hatte aber den Blütenstand von Bucephalandra fehlerhaft beschrieben und abgebildet. Also hat Beccari Microcasia irrtümlich als neue Gattung beschrieben, und der Name ist ein Synonym des älteren Namens Bucephalandra (siehe Bogner & Hay 2000).
Bis 2000 wurden weitere Arten beschrieben. Hier eine Übersicht über alle bisherigen Microcasia- und Bucephalandra-Artnamen, Stand Juli 2013:
| Name | Beschreiber, Jahr | Sammler, Jahr, Fundort des Typus | Links zu Fotos von Herbarbögen |
|---|---|---|---|
| Bucephalandra motleyana | Heinrich Wilhelm Schott, 1858 | James Motley, Süd-Kalimantan, wahrscheinlich bei Banjarmasin (Boyce & Wong 2012) | http://apps.kew.org/herbcat/getImage.do?imageBarcode=K000291662 |
| Microcasia pygmaea, von Boyce & Wong (2012) umkombiniert: Bucephalandra pygmaea | Odoardo Beccari, 1879 | Odoardo Beccari, 1867, Sarawak, Sarikei Division, Julau, Sungai Entabai | http://ww2.bgbm.org/herbarium/view_large.cfm?SpecimenPK=97143&idThumb=297739&SpecimenSequenz=1&loan=0 |
| Microcasia elliptica | Heinrich Gustav Adolf Engler, 1879 | Odoardo Beccari, 1866, wahrscheinlich im Kalkstein-/Karstgebiet des Mt. Penrissen, Südwest-Sarawak (Boyce & Wong 2012) | |
| Microcasia muluensis | Mitsuru Hotta, 1965 | Mitsuru Hotta, 1964, Sarawak, Miri, entlang des Sungai Payau von Sungai Melinau Paku bis Rubang Payau, Fuß des Gunung Mulu | |
| Microcasia oblanceolata | Mitsuru Hotta, 1965 | Mitsuru Hotta, 1964, Sultanat Brunei, Provinz Temburong, Umgebung von Labu, Bukit Peradayan | |
| Bucephalandra gigantea | Josef Bogner, 1984 | F.H. Endert, 1925, Ost-Kalimantan, westlich Koetai (= Kutai), Kiau River (ursprünglich als Piptospatha sp. bestimmt) | http://apps.kew.org/herbcat/getImage.do?imageBarcode=K000291661 |
| Bucephalandra catherineae | Peter C. Boyce, Josef Bogner & Simon J. Mayo, 1995 | E.F. de Vogel & P.J. Cribb 1991, Ost-Kalimantan, Apo Kayan, östlich von Long Nawan, Gunung Sungai Pendan, östlicher Bergkamm | |
| Bucephalandra magnifolia | H. Okada & Y. Mori, 2000 | H. Okada & D. Komara, 1990, Ost-Kalimantan, Bulungan, Long Bawan, Gunung Malim |
In der vorletzten Bearbeitung von Bucephalandra (Bogner & Hay 2000) werden nur zwei Arten akzeptiert: B. gigantea Bogner, eine bis über 40 cm hohe, großblättrige Pflanze, die bislang nur einmal gefunden wurde und wahrscheinlich nicht in Kultur ist, und B. motleyana Schott als sehr formenreiche, auf Borneo weit verbreitete Art, mit allen restlichen Bucephalandra- und Microcasia-Artnamen als Synonymen. Dieses Konzept wird z.B. von Tomey (2004) und Kasselmann (2010) übernommen. Aquarianer in Europa lernten unter dem Namen Bucephalandra motleyana zuerst die Pflanzen kennen, die Wim Tomey aus West-Kalimantan mitgebracht hatte (siehe Tomey 2004). Diese seit ca. zehn Jahren kultivierten Pflanzen gelten oft als „die Art“ B. motleyana. Die vielen in den letzten Jahren importierten Pflanzen werden hingegen oft als neue, eventuell noch unbeschriebene Arten im Internet vorgestellt. Meistens werden sie als Bucephalandra sp. mit einem angehängten Fundort-, beschreibenden oder Fantasienamen bezeichnet, wie B. sp. “Bodok“, “Gunung Sumpit“, “Kapit“, „Kualakuayan“, “Melawi“, “Pancuraji“, “Riam Macam“, “Riam Seterap“, Semuntai“, “Sekadau 1“,“Sekadau 2“,“Bukit Kelam / Sintang“, „Kedagang“, „Brownie Brown“, “Fine Edge“, „Velvet Leaf“, „Metallic Wave“, „Midnight Blue“, „Sexy Pink“, „Narcissus“, „Ulysses“, um nur wenige zu nennen. Laufend kreieren Händler und Sammler in Asien neue Namen, von denen mittlerweile um die 200 im Netz zu finden sind (Information von Tomasz Wastowski). Fundortnamen sind öfter falsch geschrieben, z.B. ist mit „Kedagang“ und „Kudakan“ wahrscheinlich der Ort Kudangan in Süd-Kalimantan gemeint, und „Pancuraji“ und „Riam Macam“ beziehen sich auf die Wasserfälle Pancur Aji und Riam Macan im Regierungsbezirk Sanggau in West-Kalimantan (Informationen von Thomas Rudolph).
Ich schrieb im Forum von www.flowgrow.de, dass auch alle „neuen Bucephalandra-Arten“ im Aquarienhobby zu der einen Art Bucephalandra motleyana gehören sollten, wenn sie a) die Gattungs-Merkmale von Bucephalandra haben und b) nicht zur Art B. gigantea gehören.
Tatsächlich findet man in Bogner & Hay‘s B. motleyana-Beschreibung viel von der Variationsbreite wieder, die man bei den unzähligen kultivierten Formen sehen kann. Hier einige von den Merkmalen nach Bogner & Hay (2000):
- Höhe 5-20 cm (einige kultivierte Bucephalandras bleiben aber deutlich kleiner als 5 cm),
- Blattspreiten (0,7-)5-7(-10) cm lang und (0,3-)2-2,8 cm breit,
- Blattstiele 1-8 cm lang und 2-2,5 mm dick, rötlich, oberseits rinnenförmig,
- Rhizom eher gestaucht, kriechend mit aufsteigender Sprossspitze, 3-10 cm lang und 4-8 mm dick (bei einigen kultivierten Pflanzen dünner),
- Blattform variabel, von linealisch über sehr schmal verkehrt-lanzettlich und elliptisch bis verkehrt-eiförmig,
- Blattspreitenbasis keilförmig, Blattspitze spitz bis stumpf oder rund, mit einem dünnen, 1-2,5 mm langen Spitzchen, Blütenstands-Stiel (Pedunkulus) 2-13 cm lang, rötlich gefärbt.

Aber man sollte doch nicht alle kultivierten Bucephalandras einfach zu B. motleyana stellen. Das aktuellste Paper über Bucephalandra-Taxonomie ist das von Peter C. Boyce und Sin Yeng Wong (2012). Sie haben im Jahr 2011 Microcasia pygmaea ca. 145 Jahre nach Beccari in der Natur wiedergefunden, als eigenständige Art erkannt und den Artnamen deshalb zur Gattung Bucephalandra umkombiniert. Fünf Arten werden von ihnen vorläufig akzeptiert:
- B. gigantea Bogner,
- B. motleyana Schott (im weiteren Sinne),
- B. catherineae P.C. Boyce, Bogner & Mayo,
- B. magnifolia Okada & Mori,
- B. pygmaea (Beccari) Boyce & Wong.
Boyce & Wong haben die als Microcasia elliptica, M. muluensis und M. oblanceolata beschriebenen Bucephalandra-Formen noch nicht als lebende, blühende Pflanzen untersucht, deshalb konnten sie noch nicht klären, ob es eigenständige Arten sind. Aus diesem Grund haben die Autoren diese Namen vorerst nicht zu Bucephalandra umkombiniert. Sie erwähnen, dass im Gunung Mulu-Nationalpark (Sarawak) mindestens zwei Arten vorkommen: Eine, die sehr wahrscheinlich Microcasia muluensis entspricht, ist auf Kalkstein, eine andere ist auf Schiefer und Sandstein beschränkt.
Boyce & Wong (2012) schreiben auch, dass es wahrscheinlich noch ziemlich viele unbeschriebene Arten gibt. Man möchte meinen, dass dies bei dem sehr unterschiedlichen Aussehen der kultivierten Bucephalandras selbstverständlich ist, zumal die Unterschiede offenbar genetisch fixiert sind: sie werden nicht einfach nur durch unterschiedlichen Wuchsbedingungen hervorgerufen (Umweltplastizität), sondern bleiben in Kultur unter gleichen Bedingungen erhalten. Und man mag vielleicht hoffen, dass es in Zukunft einmal „richtige“ botanische Namen für die unzähligen Pflanzen geben wird, die im Moment Fundort-, beschreibende oder Phantasiebezeichnungen haben. So einfach ist es aber nicht. Abgesehen von der sehr großblättrigen B. gigantea unterscheiden Boyce & Wong die Arten in erster Linie an unscheinbaren, kleinen, ziemlich schwer zu erkennenden Merkmalen der Blütenstände. (Welche Merkmale das im Einzelnen sind, ist weiter unten aufgelistet.) Blattmerkmale spielen hier nur eine untergeordnete Rolle. Nicht etwa, dass die Wissenschaftler die vielen Unterschiede zwischen den Pflanzen in Wuchshöhe, Blattform, -größe usw. nicht kennen würden. Im Gegenteil: sowohl Bogner & Hay als auch Boyce & Wong haben umfangreiche Bucephalandra-Aufsammlungen von der ganzen Insel Borneo untersucht und betonen die Vielgestaltigkeit dieser Pflanzen. Also ist dieser Formenreichtum an sich nichts wissenschaftlich Neues. Möglicherweise stammen viele von Botanikern gesammelte Bucephalandra-Herbarbelege von Fundorten, an denen später auch Pflanzen für den Handel gesammelt wurden.
Es ist auch nicht so, dass die Blattmerkmale von vorneherein als unwichtig abgetan werden. Der Grund, warum Bogner & Hay neben B. gigantea trotz aller Unterschiede nur B. motleyana (auch keine Unterarten oder Varietäten) akzeptieren, ist der: Wenn man viele Bucephalandra-Populationen zusammen betrachtet, finden sich viele Zwischenformen bzw. fließende Übergänge bei den vegetativen Merkmalen (= Merkmale der Pflanzen ohne die Blüten). Die Variation ist kontinuierlich. Auch einzelne Pflanzen vom selben Fundort können sich voneinander unterscheiden. Also sind die vegetativen Merkmale allein schlecht dazu geeignet, taxonomische Gruppen innerhalb von Bucephalandra (außer B. gigantea) abzugrenzen.

Von Bogner & Hay (2000) werden auch die variablen Blütenstands-Merkmale nicht zur Abgrenzung von Bucephalandra-Arten verwendet.
Genau hier ist aber der Punkt, in dem Boyce & Wong (2012) zu neuen Erkenntnissen gekommen sind. Normalerweise wird bei taxonomischen Arbeiten vor allem Herbar-Material untersucht. Boyce & Wong untersuchten aber außerdem viele lebende Bucephalandra-Pflanzen an den Naturstandorten und in Kultur und stellen erst dadurch fest, dass sich die Pflanzen anhand der Blütenmerkmale sehr wohl in Gruppen einteilen lassen. Bei getrockneten Bucephalandra-Exemplaren in den Herbarien seien aber die Blütenstände oft nur schwierig zu untersuchen bzw. schlecht erhalten. Darum fällen Boyce & Wong ihre taxonomischen Entscheidungen erst, wenn sie die lebenden Pflanzen und ihre dreidimensionale Blütenkolben-Struktur untersucht haben.

Wahrscheinlich werden auch die zukünftig beschriebenen Bucephalandra-Arten vor allem an Details des Blütenstands unterschieden. Auch innerhalb dieser Arten wird es sicherlich Variation geben, wenn vielleicht auch nicht so sehr wie in Bogner & Hay’s Beschreibung von B. motleyana. Wie Flair Wang (2012) schreibt, können einerseits unterschiedlich aussehende B.-Formen zur gleichen Art, andererseits sehr ähnliche Pflanzen zu verschiedenen Arten zählen. Das wird sicher denjenigen bekannt vorkommen, die sich schon einmal mit der Unterscheidung von Cryptocoryne-Arten beschäftigt haben.
Zwei neue Artnamen werden schon verwendet, sind aber noch nicht gültig publiziert worden: Bucephalandra akantha (siehe Wong & Boyce 2013) und B. belindae. Fotos im Internet zeigen als B. belindae eine Pflanze mit sehr schmal-linealischen Blättern mit welligem Rand.
Ich versuche zu erklären, woran die Gattung Bucephalandra von anderen Gattungen und die einzelnen Arten voneinander unterschieden werden. Dazu ich hole hier weiter aus und schreibe zunächst Allgemeines über Aronstabgewächse und die Tribus Schismatoglottideae.
Merkmale von Araceen

Die Blütenpflanzen-Familie Araceae (Aronstabgewächse, Araceen) ist sehr vielgestaltig und enthält mehr als 3000 Arten weltweit, sie hat die größte Artendichte im tropischen Amerika sowie auf dem Festland und den Inseln Südostasiens (Mayo & andere 1997). Aronstabgewächse sind den Aquarianern besonders durch Cryptocoryne, Anubias und Pistia bekannt. Auch durch populäre tropische Zierpflanzen wie Anthurium (Flamingoblume), Dieffenbachia , Epipremnum (Efeutute), Monstera, Philodendron und Spathiphyllum (Einblatt) sowie durch einige tropische Nutzpflanzen wie Taro (Colocasia) sind Araceen für viele ein gewohnter Anblick. Aber auch die im Aquarienhobby nicht gerade beliebten Wasserlinsen (früher Familie Lemnaceae, jetzt Unterfamilie Lemnoideae) werden seit einiger Zeit bei den Araceen eingeordnet – unter ihnen die kleinsten Blütenpflanzen der Welt (Wolffia). In Mitteleuropa kommen neben Wasserlinsen nur wenige andere Araceen vor, wie der Gefleckte Aronstab (Arum maculatum) und die Sumpf-Schlangenwurz (Calla palustris). Typische Araceen-Blütenstände wie die von Anthurium (Flamingoblume) oder Anubias werden oft für eine einzelne große Blüte gehalten, aber enthalten viele winzige, unscheinbare, ungestielte Blüten. Diese sitzen an einem Blütenkolben (Spadix), der sich am Ende des Blütenstängels (Pedunculus) befindet. Die Früchte, die sich aus befruchteten Blüten am Kolben entwickeln und die Samen enthalten, sind meistens Beeren. Der Kolben ist an der Basis von einem oft auffälligen, Blütenblatt-ähnlichen Hochblatt (Spatha) umgeben. In einfachen Fällen wie Spathiphyllum ist der Kolben mit vielen zwittrigen, gleichartigen Blüten besetzt und liegt frei.
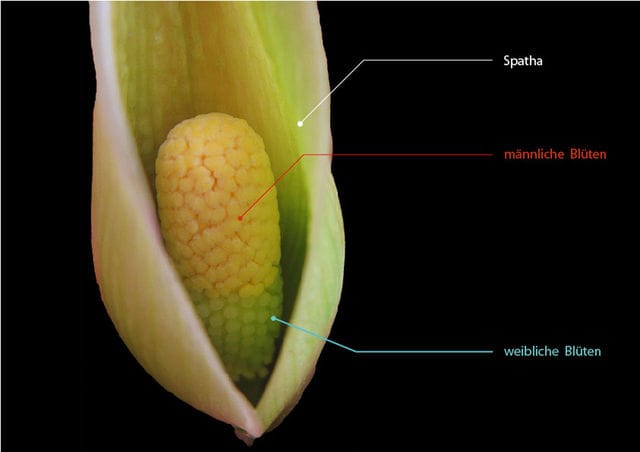
Aber besonders in der Unterfamilie Aroideae ist der Blütenstand vielfältig abgewandelt. Oft hat der Kolben unten eine Zone mit weiblichen, weiter oben mit männlichen Blüten. Auch Staminodien (in diesem Fall sind blütenähnliche, aber unfruchtbare Organe gemeint), unterschiedlich geformte Kolben-Endstücke (Appendices, Einzahl: Appendix), Duftkörper oder kahle Kolbenbereiche kann es geben. Die einzelnen Blüten können sehr reduziert sein und z.B. aus jeweils nur einem Staubblatt bzw. einem Fruchtknoten bestehen. Die Spatha verbirgt oft den Kolben mehr oder weniger und kann im unteren Teil als Kessel ausgebildet sein. Bei Cryptocoryne z.B. ist der dünne, zarte Kolben äußerlich nicht zu sehen. Die vielfältigen Ausbildungen von Blütenkolben und Spatha hängen mit Bestäubungsmechanismen zusammen. Oft werden die bestäubenden, mit Pollen von einem anderen Blütenstand beladenen Insekten zuerst zu den weiblichen Blüten, dann zu den später reif werdenden, Pollen produzierenden männlichen Blüten geleitet.
Merkmale von Schismatoglottideae

Wie schon erwähnt, gehört Bucephalandra zur Tribus Schismatoglottideae. Diese Araceen-Verwandtschaftsgruppe ist vor allem im tropischen Südostasien verbreitet und hat ihr Vielfaltszentrum auf Borneo. Die meisten Arten aus dieser Gruppe werden zur namengebenden Gattung Schismatoglottis gezählt, daneben gibt es eine Anzahl von kleineren Gattungen: Apoballis , Aridarum, Bakoa, Bucephalandra, Furtadoa, Hestia, Hottarum, Ooia, Phymatarum, Pichinia, Piptospatha und Schottariella. Eventuell werden zukünftig noch weitere Gattungen unterschieden.
Am nächsten mit der Tribus Schismatoglottideae verwandt ist die Tribus Cryptocoryneae mit den ebenfalls tropisch-asiatischen Gattungen Cryptocoryne und Lagenandra.
Früher rechnete man auch drei Arten aus dem tropischen Südamerika zu Schismatoglottis. Heute sind sie in der Gattung Philonotion , und man hat für sie eine neue Tribus aufgestellt: Philonotieae. Diese südamerikanische Artengruppe gilt stammesgeschichtlich gesehen als die Schwestergruppe von Schismatoglottideae + Cryptocoryneae (siehe Wong & andere 2010). Der letzte gemeinsame Vorfahre all dieser Pflanzen – also auch von Bucephalandra, Cryptocoryne und Lagenandra – war also wahrscheinlich eine Schismatoglottis-ähnliche Pflanze. Sehr viele Arten aus der Tribus Schismatoglottideae sind Rheophyten (an häufige Überflutungen mit starker Strömung angepasste Pflanzen, siehe weiter unten), aber eher die Arten aus den kleineren Gattungen. Die meisten Schismatoglottis-Arten sind hingegen „forest herbs“, krautige Landpflanzen auf dem Boden von Tropenwäldern. Verschiedene Arten wie S. pseudohatchii mit auffällig silbrig gezeichneten breiten Blättern werden als Zierpflanzen verwendet. Aber es gibt auch einige schmalblättrige Rheophyten unter ihnen wie die aquariengeeignete Schismatoglottis roseospatha.

Bei vielen Schismatoglottideae fällt während des Blühens der obere Teil der Spatha ab, so dass der obere Kolbenteil mit den männlichen Blüten freigelegt wird. Meistens löst sich später auch der obere Kolbenteil ab. Der untere Spatha-Teil bleibt am Blütenstand und umhüllt dann die reifenden Früchte (Beeren mit vielen Samen). Bei Schismatoglottis (von griechisch schisma „Spaltung, Teilung“ und glotta „Zunge“) ist die Spatha an der „Sollbruchstelle“ zwischen oberem und unterem Spatha-Teil eingeschnürt.

Bei verschiedenen anderen Gattungen wieAridarum, Bucephalandra und Piptospatha ist die Spatha nicht eingeschnürt, aber auch bei ihnen löst sich der obere Spatha-Teil vom unteren während des Blühens ab. Der untere Spatha-Teil, der am restlichen Blütenstand verbleibt, vergrößert sich und sieht dann wie ein Becher oder Trichter aus. In ihm entwickeln sich die Früchte (Beeren) mit den Samen.

Solche trichterförmigen Fruchtstände sind oft auf Fotos von Bucephalandra und Verwandten an den Naturstandorten zu sehen. Man vermutet, dass die Samenverbreitung nach dem „Splash cup“-Mechanismus funktioniert (Boyce & Wong 2008b): In den Becher fallende Spritzwasser- oder Regentropfen schleudern das Fruchtfleisch mit den reifen Samen heraus.

Bei vielen Schismatoglottideae (auch Bucephalandra und Schismatoglottis roseospatha) haben die Blattscheiden eine besondere Form. Sie sind fast auf ihrer ganzen Länge vom Blattstiel abgelöst und bilden einen sogenannten ligularen Teil. Dieser umhüllt wie eine Tüte das jeweils jüngste, austreibende Blatt. Zwischen älteren Blättern sind diese freien Blattscheiden als stielähnliche, spitze Gebilde zu sehen.

Die Blatt-Oberseite von Bucephalandra und Schismatoglottis roseospatha hat viele winzige, aber ziemlich auffällige, unter Wasser silbrig aussehenden Pünktchen. Mit einem Mikroskop erkennt man, dass es Spaltöffnungen (Stomata) sind, die auf Erhebungen sitzen. Sie sind auch auf der Blattunterseite, in viel größerer Dichte. Bei Landpflanzen befinden sich die Spaltöffnungen meistens auf der Blattunterseite (Abaxialseite), aber besonders bei Wasser- und Sumpfpflanzen auch auf der Oberseite (Adaxialseite). Herausgehobene (auf einer Erhebung sitzende) Spaltöffnungen sind typisch für Hygrophyten (Pflanzen von dauernd feuchten Standorten). Der silbrige Glanz unter Wasser kommt offensichtlich durch die Luft zustande, die sich direkt hinter den Spaltöffnungen in den Zell-Zwischenräumen (Interzellularen) des Blattgewebes befindet und das Licht reflektiert.

Bei genauem Hinschauen entdeckt man auch auf Unterwasserblättern von vielen anderen Aquarienpflanzen wie z.B. Anubias-, Cryptocoryne-, Hygrophila-, Staurogyne- und Pogostemon-Arten solche hellen Pünktchen (also Spaltöffnungen), nur sind sie dort meistens kleiner und unauffälliger als bei Bucephalandra und Verwandten. Viele echte Unterwasserpflanzen haben hingegen nur spärliche oder gar keine Spaltöffnungen.
Unterscheidung zwischen Bucephalandra und ähnlichen Schismatoglottideae
Bucephalandra-Pflanzen können äußerlich manchen Pflanzen aus verwandten Gattungen wie Aridarum, Hottarum und Piptospatha sehr ähnlich sehen. Man kann die Gattungen eigentlich nur dann sicher bestimmen, wenn die Pflanzen blühen. Dazu muss man den Blütenkolben freipräparieren und mit einer Lupe oder einem Binokular anschauen. Am besten sind reife Blütenstände in der Zeit wenn sich die Spatha öffnet bis kurz nachdem der obere Spatha-Teil abgefallen ist. Man schneidet die Spatha vorsichtig mit einer scharfen Klinge von der Basis ab und entfernt sie mit einer spitzen Pinzette, bis der ganze Blütenkolben (Spadix) zu sehen ist. Massimo Iannella führt das in einem Youtube-Video vor: http://www.youtube.com/watch?v=WWN4PAzH5cA
Zum Konservieren kann man die Blütenstände z.B. in 70%iges Ethanol legen.
Bei allen Schismatoglottideae sitzen unten am Kolben die weiblichen Blüten und weiter oben die männlichen Blüten. Bei Bucephalandra sind die einzelnen Blüten extrem vereinfacht, die weiblichen Blüten bestehen jeweils nur aus einem Fruchtknoten und die männlichen aus je einem Staubblatt. Der Blütenkolben endet oben in einem Appendix („Anhang“), dicht besetzt mit vielen am Ende gestutzten Staminodien. Dieser Appendix sieht rundlich bis abgerundet-kegelförmig oder stumpf-zylindrisch aus und ist oft weißlich bzw. cremeweiß gefärbt.
Bucephalandra unterscheidet sich von anderen Araceen am deutlichsten dadurch, dass zwischen weiblicher und männlicher Blütenzone am Kolben abgeflachte, schuppenförmige Staminodien sitzen. Sie überragen deutlich die weiblichen Blüten. Weil sie in einem Zwischenraum (Interstitium) zwischen den männlichen und weiblichen Blüten sitzen, werden sie auch interstitiale Staminodien genannt.

Das Staubblatt der männlichen Blüte hat nebeneinander zwei Verdickungen, die Theken (Staubbeutel-Hälften), in denen sich der Pollen entwickelt. Bei Bucephalandra hat jede Theke einen nadel- oder hornförmigen Vorsprung. An der Spitze der beiden „Hörner“ einer männlichen Blüte tritt der Pollen als Tröpfchen aus. Die männlichen Blüten wurden mit einem gehörnten Kuh- oder Stierkopf verglichen, daher der Name Bu-cephal-andra (von griechisch bous = Rind; kephale = Kopf; aner, andros = Mann (Mayo, Bogner & Boyce 1997)).
Auch Aridarum und Phymatarum haben gehörnte Theken, aber keine schuppenförmigen Staminodien. Aridarum kann zwischen männlichen und weiblichen Blüten zwar auch Staminodien haben, aber diese sind dann nicht schuppenförmig, sondern kurz, gestutzt und unauffällig. Außerdem sind die Staubblätter von vielen Aridarum-Arten vorn ausgehöhlt, und in dieser Grube sitzen die Theken des Staubblatts mit ihren „Hörnern“. Dadurch sieht die männliche Blütenzone oft etwas bienenwabenähnlich aus. Bei den Staubblättern von Bucephalandra hingegen sind die Theken vorgewölbt und sitzen nicht in einer Grube.

Bei Phymatarum ist die Spatha zwischen männlicher und weiblicher Blütenzone verengt, wie bei Schismatoglottis. Bei Bucephalandra und Aridarum ist sie nicht verengt. Andere Schismatoglottideae, bei denen die Spatha auch keine Einschnürung hat, wie Bakoa, Hottarum, Ooia und Piptospatha, haben anders als Bucephalandra und Aridarum keine „Hörner“ auf den Theken der männlichen Blüten.
Aronstabgewächse aus Borneo gehören also zu Bucephalandra , wenn die folgenden Merkmale kombiniert auftreten:
- nicht eingeschnürtes Hochblatt (Spatha),
- auffälliger, mit vielen gestutzten Staminodien besetzter Appendix am Kolben-Ende, oberhalb der männlichen Blütenzone,
- männliche Blüten mit zwei „Hörnern“,

Unterscheidung der zur Zeit akzeptierten Bucephalandra-Arten (Stand 2014)
Die Blütenstands-Merkmale, die Boyce & Wong (2012) zur Artunterscheidung verwenden, sind:
- Oberflächenbeschaffenheit der Staminodien, die am sterilen Endstück (Appendix) des Blütenkolbens sitzen: warzig (papillös) oder glatt, mit Furchen usw.
- Form des Staubfadens (Filament) der männlichen Blüte, z.B. pyramiden-, block-, bandförmig. Schwierig zu erkennen, man muss dazu die einzelnen männlichen Blüten von der Seite anschauen.
- Stelle (Insertionsstelle), an der die zwei Theken am Staubfaden der männlichen Blüten sitzen.
- Länge der Hörner im Verhältnis zur Länge der Theken, auf denen die Hörner sitzen.
- Richtung, in die die Hörner der Theken in der späteren (männlichen) Blühphase zeigen: nach schräg oben oder nach außen. Am Anfang der Blühphase sind bei allen Arten sowohl die Hörner als auch die schuppenförmigen Staminodien nach oben gerichtet.
- Unterkante des Rands der schuppenförmigen Staminodien: deutlich erhöht oder nicht.

In der folgenden Tabelle habe ich Merkmale aus dem Bucephalandra-Bestimmungsschlüssel und der Beschreibung von B. pygmaea aus Boyce & Wong (2012) sowie aus der Beschreibung von B. gigantea aus Bogner & Hay (2000) zusammengestellt:
| B. gigantea | B. motleyana im weiteren Sinne | B. magnifolia | B. pygmaea | B. catherineae | |
|---|---|---|---|---|---|
| Wuchshöhe | 40 cm und mehr | meistens viel weniger als 25 cm (B. pygmaea: 1-3 cm) | |||
| Blattspreite, Größe | bis 25 cm lang, 6-7 cm breit | deutlich kleiner, nicht über 20 cm lang (B. pygmaea: (0,7-)2,5 cm lang, 1-1,5 cm breit) | |||
| Blattspreite, Form | elliptisch | keine Angabe (variabel) | keine Angabe | elliptisch-verkehrt-lanzettlich bis schwach spatelförmig | linealisch-elliptisch |
| Zahl der stärkeren (primären) Seitennerven beiderseits der Mittelrippe | 16-20 | (0-)1-4, sehr schwach (B. pygmaea: (1-)3-4) | |||
| Blattstiel | deutlich differenziert, 15-20 cm lang | keine Angabe (deutlich differenziert) | keine Angabe (deutlich differenziert) | deutlich differenziert, 1,5-2 cm lang | nicht deutlich differenziert |
| Durchmesser des Rhizoms | ca. 1 cm | weniger als 1 cm (B. pygmaea: 2-4 mm) | |||
| Oberfläche der Staminodien des Appendix | warzig | warzig (papillat-tuberculat) | glatt, mit tiefer U- oder T-förmiger Naht | glatt | glatt |
| Staubfaden (Filament des Staubblatts), Form in Seitenansicht | keine genaue Angabe (mehr oder weniger gestutzt) | keine Angabe | schräge oder ungleichseitige Pyramide | stark abgeflacht, bandförmig | rautenförmig (rhomboid), blockartig |
| Stelle am Staubfaden, an der die Theken sitzen | Unterseite | keine Angabe | keine Angabe | Unterseite | äußeres Ende |
| Hörner der Theken | aufwärts gerichtet | keine Angabe | keine Angabe | so lang wie die zugehörige Theke, bleiben aufwärts gerichtet | viel kürzer als die zugehörige Theke, nach außen gerichtet |
| Unterkante des Rands der schuppenförmigen Staminodien | keine Angabe | keine Angabe | keine Angabe | auffällig erhöhter Rand | nicht erhöhter Rand |

Wie lässt sich nun die botanische Arteinteilung nutzen, um kultivierte Bucephalandras zu unterscheiden? Im Moment wohl nur sehr beschränkt, das wird sich vielleicht mit der Beschreibung weiterer Arten ändern. Aber auch dann werden sicherlich mehrere kultivierte Formen unter jeweils eine Art fallen. Im Zweifelsfall ist es doch besser, die Pflanzen wieder als unbestimmte Arten (Bucephalandra sp.) mit bisherigen Fundort- oder Handelsnamen zu bezeichnen. Sicher ist aber, dass Bucephalandra sp. „Kapit“ (= B. motleyana „Kapit“) zu Bucephalandra pygmaea zählt. Die ursprünglich als Microcasia pygmaea beschriebene Art wurde zuerst in West-Sarawak in der heutigen Verwaltungsdivision Sarikei gefunden. Beccari bezeichnete sie 1879 als das kleinste Aronstabgewächs („La più piccola delle Aracee“), und tatsächlich bleiben die Pflanzen sowohl in der Natur als auch in Kultur mit ca. 3,5 cm Höhe ziemlich klein (das kleinste Aronstabgewächs und die kleinste Blütenpflanze überhaupt ist die Zwergwasserlinse Wolffia globosa). Typische Blütenstandsmerkmale sind u.a. der ziemlich glatte (nicht warzig-raue) Appendix des Blütenkolbens, männliche Blüten mit nach oben gerichtet bleibenden Hörnern, die etwa so lang sind wie die zugehörigen Theken, und der auf der Unterseite auffällig verdickte Rand der schuppenförmigen Staminodien. Peter Boyce und Sin Yeng Wong sammelten B. pygmaea im August 2011 im Süden von Sarawak, Verwaltungsdivision Kapit, Taman Rekreasi Sebabai. Ihre Fotos im Paper von 2012 zeigen die gleichen Pflanzen und das gleiche braune Schiefergestein wie auf Bildern, die Händler bzw. Sammler vom Naturstandort von Bucephalandra sp. „Kapit“ gemacht haben. Die Art kommt vor allem auf Schiefer, seltener auf Sandstein vor.

Die Blätter von B. pygmaea variieren in Blattform und –farbe, und im Hobby werden mehrere „Kapit“-Auslesen genannt („Kapit 1“, „Kapit 2“, „Red“, „Green“ usw.). Wenn man diese weiterhin unterscheiden möchte, reicht der botanische Name nicht aus, aber man kann in solchen Fällen die bisherigen nicht-wissenschaftlichen Namen in Anführungszeichen anhängen. Es macht meiner Meinung nach Sinn, den Fundortnamen „Kapit“ weiter zu verwenden, weil die Art B. pygmaea nicht nur dort, sondern auch in Sarikei gefunden wurde – also Bucephalandra pygmaea „Kapit 1“ usw.
Michael Lo hat am unteren Rajang-Fluss bei Kanowit (Sarawak, Sibu Division) Pflanzen gefunden, die Blütenstands-Merkmale von B. pygmaea zeigen, aber viel längere Blätter haben (Blog-Eintrag vom 03.09.2012, http://junglemikey.blogspot.de/2012/09/bucephalandra-dark-velvet-is-actually.html ). Er fand sie zum größten Teil submers wachsend, zusammen mit Cryptocoryne striolata. Lo nennt die Pflanzen von Kanowit vorläufig Bucephalandra sp. „Dark Velvet“, und sie sollen eine neue, noch unbeschriebene, mit B. pygmaea verwandte Art darstellen.
Der Name B. catherineae wird im Hobby für eine kultivierte Bucephalandra verwendet, aber ich kenne den Blütenstand nicht und kann daher nicht beurteilen, ob die Pflanze richtig bestimmt wurde. Sie sieht auf Fotos im Internet so aus wie die als B. sp. „Fake Catherineae“ und „B. belindae“ bezeichneten Pflanzen mit sehr schmal-linealischen, welligen Blättern. Bei der breitblättrigeren B. sp. „Melawi“ scheinen die Blütenstände zur Beschreibung von B. catherineae zu passen. Die Pflanze, nach der die Art B. catherineae ursprünglich beschrieben wurde (also der Typus), hat 1,5-3 mm breite, linealische, sehr ledrige Blätter mit nach unten gebogenem, nicht welligem Rand (siehe Boyce, Bogner & Mayo 1995), anders als B. sp. „Melawi“. Bucephalandra sp. „Sekadau 1“ (vielleicht mit „B. belindae“ identisch?) sieht „Melawi“ ähnlich, aber hat schmalere Blätter. Der Appendix des Blütenkolbens sieht bei „Sekadau 1“ warzig-rau aus, das führt im Bestimmungsschlüssel von Boyce & Wong (2012) zu Bucephalandra motleyana(!).

Der Fall Bucephalandra motleyana
Wie schon erwähnt, versteht man im Aquarienhobby unter Bucephalandra motleyana in erster Linie die Pflanzen, die Wim Tomey vor etwa 10 Jahren aus West-Kalimantan nach Europa eingeführt hatte. Schon in dieser Aufsammlung waren unterschiedliche Formen, sie wurden im Hobby aber nur als „die Art“ B. motleyana weitergegeben. Zwei Auslesen werden aber in letzter Zeit als B. motleyana „Braun-rot“ und „Braun-rot narrow“ bezeichnet. Tomey (2004) stellt in seinem Artikel in der Aqua Planta auch eine grünblättrige Form vor, diese hat sich aber wohl nicht unter Aquarianern verbreitet.

Tomeys Pflanzen, die im Hobby oft als „die“ B. motleyana angesehen werden, entsprechen zwar der weit gefassten Definition von B. motleyana nach Bogner & Hay (2000), aber zumindest „Braun-rot“ ist nach meiner Meinung nicht B. motleyana im Sinne von Boyce & Wong (2012). Der Appendix des Blütenkolbens ist ziemlich glatt, nicht warzig, und damit kommt man im Bestimmungsschlüssel in Boyce & Wong’s Paper nicht zu B. motleyana. Zu welcher Art diese Pflanzen aus Tomeys Aufsammlung gehören, konnte ich nicht herausfinden. Aber gerade unter den später importierten „neuen Arten“ gibt es welche, die nach Boyce & Wong‘s Bestimmungsschlüssel eher zu B. motleyana passen. Man kann Bucephalandra-Formen vorerst unter diesem Namen einsortieren, wenn sie
- nicht zu B. gigantea, die wahrscheinlich sowieso nicht in Kultur ist, gehören (siehe Blatt-Merkmale in der Tabelle oben) und
- der Appendix (das dicht mit gestutzten Staminodien besetzte Blütenkolben-Ende) keine eher glatte, sondern deutlich rau, warzig aussehende (papillate bis tuberculate) Oberfläche hat.
Zumindest bei den großwüchsigen B. motleyana „Pancuraji“ (Fundort Pancur Aji in West-Kalimantan) und „Riam Seterap“, aber auch bei der kleinen, schmalblättrigen B. sp. „Sekadau 1“ ist das der Fall. Vielleicht auch bei verschiedenen anderen kräftig und groß werdenden Formen („Gunung Sumpit“, „Sungai Ayak“, „Sekadau 2“, „Bodok“, „Semuntai“ usw.), bei denen ich mir aber die Blütenstände nicht genau angeschaut habe.

Man muss aber beachten, dass Boyce & Wong’s Konzept von B. motleyana nur ein vorläufiges ist. Sie fassen unter diesem Namen verschiedene Bucephalandra-Populationen zusammen, unter denen es eventuell noch unbeschriebene Arten gibt. Kultivierte Formen, die man vorerst als B. motleyana bestimmen kann, zählen möglicherweise zu solchen neuen Arten in spe.
„Typische“ Bucephalandra motleyana im engsten Sinne ist vielleicht gar nicht in Kultur. Es handelt sich dabei um Pflanzen aus Süd-Kalimantan, nach denen Schott die Gattung und Art beschrieben hatte. Das Foto vom Holotypus im Kew Herbarium zeigt relativ große Pflanzen mit eher schmalen, verkehrt-lanzettlichen, spitz zulaufenden Blättern (siehe Link in der Tabelle oben). Boyce & Wong (2012) meinen, dass der unbekannte Fundort wahrscheinlich in der Umgebung von Banjarmasin liegt, weil der Sammler James Motley damals (bis zu seiner Tötung am 1. Mai 1859 bei einem lokalen Aufstand zu Beginn des Banjarmasin-Kriegs) Vorsteher eines Kohlebergwerks in einem Ort südöstlich dieser Stadt war. Sie merken auch an, dass diese eigentliche B. motleyana recht wahrscheinlich ein Lokal-Endemit (auf ein kleines Gebiet beschränkte Art) ist, und dass sie noch keine (lebende) Pflanze gesehen haben, die in überzeugender Weise dieser Art entspricht, auch wenn der Name B. motleyana fast überall in Literatur und Internet verwendet wird.

Die nicht-wissenschaftlichen Namen: notwendig, aber…
Aquarianer erwarten oft, dass ein wissenschaftlicher Name für einheitliche Pflanzen steht: „die Art“ oder „die Unterart“ soundso. Aber z.B. „der Javafarn“ (Microsorum pteropus) oder „die Cryptocoryne wendtii“ sind ebenso wenig einheitlich wie „der Guppy“ (Poecilia reticulata), und auch bei Varietäten wie Cryptocoryne crispatula var. balansae kann es Variation und Übergangsformen zu anderen Varietäten geben. Die wissenschaftliche Taxonomie kann die feinen Unterschiede zwischen individuellen, genetisch fixierten Formen einer Art nie ganz exakt widerspiegeln, sonst werden ihre Taxa (beschriebenen Einheiten) unbestimmbar. Aber es sind oft gerade diese Unterschiede ohne taxonomischen Wert, die aus Sicht der Pflanzenliebhaber für Ästhetik und gestalterischen Wert der Pflanzen entscheidend sind. Am Beispiel von Bucephalandra pygmaea möchte ich ausdrücken: Die botanischen Artnamen können bisherige nicht-wissenschaftliche Bezeichnungen (Fundort-, beschreibende, Fantasienamen) nicht ganz ersetzen, sondern nur ergänzen. Auch wenn unterschiedliche Formen nicht durch Züchtung entstanden, sondern Auslesen aus der Natur sind, könnte man sie mit einem Sorten (Cultivar)-Namen in einfachen Anführungszeichen benennen.
Doch egal wie man sie benennt, bestimmbar sind solche Einheiten nur, wenn davon nicht nur schöne Bilder, sondern auch einigermaßen genaue Beschreibungen und Unterscheidungen von ähnlichen Pflanzen veröffentlicht worden sind. Das ist bei vielen Handelsbezeichnungen nicht der Fall, und dann ist es oft unsicher, welche Pflanzen genau gemeint sind und ob es dieselben nicht schon unter anderen Namen gibt.

Aber die Abgrenz- und Bestimmbarkeit von Naturformen derselben Art wird umso schwieriger bzw. weniger möglich, je mehr von ihnen in Kultur kommen – nicht nur bei Bucephalandra-Arten, sondern generell bei variablen Arten wie Javafarn, Rotala rotundifolia oder Cryptocoryne wendtii. Auch die Veränderlichkeit (Modifikation) durch unterschiedliche Wachstumsbedingungen erschwert die Unterscheidung. Dann wird auch für die Aquarianer zunehmend deutlich, dass die Variation kontinuierlich ist, und sie können umso besser nachvollziehen, warum die Taxonomen all die unterschiedlichen Formen nur in eine oder wenige Arten stecken. Vergleichskultur (Kultur unter gleichen Bedingungen) ist eine Möglichkeit, subtile Unterschiede dingfest zu machen und von umweltbedingter Modifikation zu unterscheiden, doch bei so langsamen Wachsern wie Bucephalandra wohl sehr zeitaufwändig. Vielleicht könnte man einmal mit „DNA Fingerprinting“ einzelne Bucephalandra-Klone (genetisch gleiche Pflanzen) identifizieren, wie es z.B. bei Obst- und Rosensorten gemacht wird.
Neue Namen für Bucephalandra-Formen werden sicher meistens von Händlern bzw. Pflanzensammlern vergeben. Man wird wohl leider nicht erwarten können, dass diese sich über die Benennung von gleich aussehenden Pflanzen einigen. Unterschiedliche Namen für gleiche oder sehr ähnliche Pflanzen sind unvermeidlich, ebenso wie unterschiedliche Pflanzen unter derselben Fundortbezeichnung (z.B. „Sintang“). Wenn interessierte Hobbyisten mehr Ordnung im Namensdschungel von Bucephalandra-Formen, aber auch anderen variablen Pflanzenarten haben möchten, wird das weder der Handel noch die Wissenschaft von sich aus für sie tun, sondern sie müssten selbst die Initiative ergreifen und in einem gemeinsamen Projekt die Pflanzen mit ihren unzähligen Handelsnamen katalogisieren und beschreiben. Die wissenschaftlichen Artabgrenzungen durch die Botaniker sowie Fundort-Informationen von den Pflanzensammlern und Händlern könnten dabei zumindest eine grobe Orientierung bieten. Ob vielleicht die von Wang (2012) erwähnte „Japan Bucephalandra Fanatist Association“ schon solch ein Projekt ins Auge gefasst hat?
Rheophyten

Die Naturstandorte von Bucephalandra motleyana werden anschaulich von Tomey (2004) und Wang (2012) beschrieben, beeindruckende Bilder von den Lebensräumen zeigt z.B. Michael Lo („Jungle Mike“) auf der Seite http://junglemikey.blogspot.com/. Bucephalandra entwickelt meistens mattenartige, dichte Bestände auf Felsen und großen Steinen in der Hochwasserzone von Bächen und Wasserfällen im tropischen Regenwald, im Schatten oder Halbschatten. Die Wurzeln der Pflanzen bilden eine umfangreiche, dichte, auch auf glattem Gestein sehr fest haftende Matte. An den Rhizomen bilden sich viele Seitentriebe, durch die sich die Pflanze vegetativ vermehrt. Tomey (2004) fand in den Bucephalandra-Matten viel angesammeltes organisches Material – in den ziemlich nährstoffarmen Lebensräumen sicherlich eine Nährstoffquelle für die Pflanzen. Bucephalandra wächst auf unterschiedlichen Gesteinsarten, auch auf Kalkstein.
Rheophyt bedeutet ungefähr „Flusspflanze“ oder „Strömungspflanze“. Diese Lebensform wird ausführlich im Buch „Rheophytes of the World“ (Van Steenis 1981) beschrieben. Rheophyten wachsen an Stellen mit zumindest zeitweise reißender Wasserströmung (mindestens 1-2 Meter pro Sekunde), also in und an Bächen und rasch strömenden Flüssen bis zur mittleren Hochwasserlinie, in Stromschnellen und Wasserfällen. Dort gibt es besonders in den Tropen häufig „flash floods“ nach Regenfällen. Normale Landpflanzen können sich an solchen Standorten nicht ansiedeln, weil sie vom häufigen Hochwasser weggerissen oder zu sehr beschädigt werden. Rheophyten sind an diesen Lebensraum angepasst z.B. durch schmale, stromlinienförmige, ledrige Blätter, flexible, zugfeste Blattstiele und Stängel sowie Haftwurzeln oder weit streichende Wurzeln im Bachgeröll. Je nachdem wie sehr das natürliche Vorkommen auf diesen speziellen Lebensraum beschränkt ist, werden fakultative und obligate Rheophyten unterschieden. Bucephalandra-Arten zählen zu den letzteren.

Einige Rheophyten sind typische Wasserpflanzen unterhalb der Mittelwasserlinie, wie der u.a. in Deutschland heimische Fluss-Hahnenfuß (Ranunculus fluviatilis), aber überwiegend sind es halb-aquatische oder Landpflanzen, die nur bei Hochwasser bzw. in der Regenzeit überflutet werden. Die meisten rheophytischen Arten gibt es in den Tropen. Es sind sowohl krautige Pflanzen als auch Gehölze wie der in steinigen Bachbetten des Mittelmeerraums wachsende Oleander (Nerium Oleander) und das Falsche Heidekraut (Cuphea hyssopifolia) aus Mittelamerika. Es gibt auch viele rheophytische Farn-Arten, besonders auf Borneo. Seltsame, extrem spezialisierte rheophytische Wasserpflanzen sind die Podostemaceae („Flussunkrautgewächse“), sie sind zwar Blütenpflanzen, sehen aber oft eher wie Farne, Moose, Krustenflechten oder Seetang aus. Auch viele auf Bachsteinen vorkommende Moose können als Rheophyten angesehen werden.
Kultur

Man könnte meinen, Rheophyten wären allgemein schwierig zu kultivieren, weil sie die speziellen natürlichen Wuchsbedingungen - Wechsel zwischen Überflutung und Trockenfallen sowie starke Strömung - auch in Kultur bräuchten. Doch das scheint oft nicht der Fall zu sein. Einige klassische, sehr einfach zu haltende Aquarienpflanzen zählen zu den Rheophyten: Bolbitis heudelotii, Microsorum pteropus und Anubias barteri-Varietäten. So wie auch Bucephalandra und Schismatoglottis roseospatha sind es eher langsam wachsende, wenig lichtbedürftige Pflanzen mit Haftwurzeln. Obwohl diese Arten in der Natur meistens nur zeitweise untergetaucht sind, wachsen sie ständig submers im Aquarium, sogar in stehendem Wasser. Und emers gehaltene Rheophyten, erst recht die als normale Landpflanzen kultivierten „trockenen“ Vertreter wie der populäre Oleanderstrauch (Nerium), müssen nicht periodisch überflutet werden, damit sie gedeihen.
Eigentlich ist es erstaunlich, dass die „Bucen“ erst so spät für das Aquarienhobby entdeckt wurden, obwohl an Pflanzen interessierte Aquarianer schon oft auf der Insel Borneo unterwegs waren, besonders wegen der vielen Cryptocoryne-Arten. Falls man überhaupt Bucephalandra-Pflanzen bemerkt hat: vielleicht wurden sie als sowieso nicht für die Aquaristik interessante Landpflanzen angesehen? Ihre Aquarienkarriere begann jedenfalls, nachdem Tomey (2004) sie im Fluss Hulu Sungai Landak in bis 1,20 m Wassertiefe gefunden hatte.
Außer Bucephalandra und Schismatoglottis roseospatha sind sicher noch weitere rheophytische Pflanzen aus der Tribus Schismatoglottideae gut als Aquarienpflanzen geeignet. Im Forum von www.aquaticplantcentral.com wurde z.B. schon über submers kultivierte Piptospatha-Arten geschrieben, aber insgesamt findet man darüber bisher nur wenig.
Ausführliches über Bucephalandra-Kultivierung wäre wohl in einem eigenen Artikel besser aufgehoben. Hier etwas über bisherige Erfahrungen:
Bucephalandra kann auch in Aquarien ohne Kohlendioxiddüngung und bei Schwachlicht wachsen, entwickelt sich aber viel besser bei mindestens mittlerer Lichtstärke und guter CO2- und Nährstoffversorgung. Weiches Wasser ist wahrscheinlich generell günstig, doch einige Bucephalandra-Populationen kommen auch auf Kalk vor (ich weiß nicht, welche von den kultivierten Formen), und möglicherweise vertragen diese im Aquarium eine hohe Karbonathärte.
Nach Tomey (2004) und Wang (2012) bilden submers gewachsene Pflanzen in der Natur kleinere Blätter aus als emerse, doch die bei der Firma Aquasabi kultivierten Bucephalandras haben submers sogar größere Blätter als die alten emersen entwickelt, allerdings bei CO2-Konzentrationen um 20-30 mg/l und regelmäßiger Makro- und Mikronährstoffdüngung über die Wassersäule. Wahrscheinlich ist im Vergleich dazu das CO2- und Nährstoffangebot an den Naturstandorten unter Wasser sehr limitiert.
Zwar sind sie an sich recht pflegeleicht, aber nicht so robust wie Anubias. Rasche Änderungen der Wasserparameter quittieren sie ähnlich der „Cryptocorynenfäule“ oft mit Abwurf aller Blätter. Die kahlen Rhizome treiben danach langsam wieder aus. Oft treten bei Bucephalandra auch löchrige Blätter auf.

Bucephalandra heftet sich mit den Wurzeln besser an Gestein als an Holz fest. Man sollte sie wie Anubias und Microsorum nicht in den Boden pflanzen, doch die Wurzeln können tief in lockeren Boden vordringen. Zwar gilt Bucephalandra allgemein als extrem langsamwüchsig, doch einzelne Formen unterscheiden sich in der Wachstumsrate. B. sp. „Bukit Kelam / Sintang“, eventuell die anspruchsloseste Form, wächst ähnlich „schnell“ wie Anubias barteri var. nana, sehr langsam ist dagegen B. pygmaea.
Die Vermehrung ist wie bei anderen Rhizompflanzen einfach durch Teilung möglich. Kappen der Triebspitze fördert die Seitentriebbildung. Ich habe an abgerissenen Bucephalandra-Wurzeln hin und wieder winzige Jungpflanzen gefunden. Adventivsprosse an Wurzeln sind bei dieser Gattung offenbar noch nicht bekannt, dafür aber bei der verwandten Ooia grabowskii.

Besonders bei großwüchsigen Formen („Gunung Sumpit“, „Sungai Ayak“, „Bukit Kelam / Sintang“ usw.) wächst das Rhizom unter Wasser stängelartig aufrecht. Formen mit submers eher kriechendem, an der Spitze aufsteigendem Rhizom sind z.B. „Rot-braun“, „Rot-braun narrow“, „Riam Macan“, „Melawi“ und „Sekadau 1“, wohl auch sehr kleinblättrige Formen wie „Theia 6“.
Das gestalterische Potenzial von Bucephalandra ist sicher noch nicht ausgeschöpft. Die Pflanzen zeigen Farbtöne und -effekte, wie sie kaum von anderen Aquarienpflanzen, höchstens von einigen Cryptocorynen bekannt sind, z.B. bläulichen Schimmer und changierende Farben. Wie auch bei Cryptocoryne bilden sich die besonderen Färbungen eher unter Wasser aus. Einige Formen bleiben offenbar kleiner als B. pygmaea und dürften die kleinsten aquariengeeigneten Aufsitzerpflanzen (außer Moosen) sein, z.B. hat B. sp. „Theia 6“ nur kleinfingernagelgroße Blätter (Information von Tomasz Wastowski („vasteq“) auf www.flowgrow.de). Ich glaube, dass die Bilder von den natürlichen Bucephalandra-Biotopen sehr schöne Inspirationen für die Verwendung im Aquascaping bieten würden. Die Pflanzen blühen oft unter Wasser, das trägt zu ihrem Reiz bei, doch dort können die Blütenstände nicht bestäubt werden. Das Blühen unter Wasser kann man auch oft bei Anubias barteri-Varietäten sehen, und es hängt nach meiner Vermutung mit dem häufig wechselnden Wasserstand in der Natur zusammen: wahrscheinlich haben auch submers während des Hochwassers herangewachsene Blütenstände eine genügend große Chance, trockenzufallen und dann bestäubt zu werden. Unter den Bucephalandra-Formen gibt es offensichtlich mehr oder weniger fleißige Blüher. Das Öffnen der Spatha und der Abwurf des oberen Spatha-Teils innerhalb von Minuten ist der schnellste Vorgang, den man bei Bucephalandra im Aquarium beobachten kann.

Boyce (1995) erwähnt bei emers kultivierter Bucephalandra auch Anzucht aus Samen. Ich habe aber nichts darüber gefunden, ob die Blüten in Kultur künstlich bestäubt werden müssen, damit sie Samen ansetzen. Man bräuchte wahrscheinlich wie bei Anubias oder Cryptocoryne unterschiedlich alte Blütenstände, weil am Kolben erst die weiblichen, dann die männlichen Blüten reif werden. In der Natur wird Bucephalandra von Fruchtfliegen der Gattung Colocasiomyia bestäubt (Wong & Boyce 2013).
Für die emerse Kultur empfiehlt Boyce (1995) kleine Töpfe und grobes, durchlässiges, aber wasserhaltendes Substrat, feucht, aber nicht staunass, bei hoher Luftfeuchte in einem geschlossenen Behälter und einer Minimumtemperatur von 20 °C. Siehe auch die Kulturbeschreibung von Tomey (2004). Wie man auf verschiedenen Webseiten sehen kann, kultivieren japanische Hobbyisten die Pflanzen emers offenbar in einem Typ von granuliertem Erdsubstrat (Aquasoil?). Auch in Steinwolle und Nährlösung, wie in Wasserpflanzengärtnereien üblich, können die Pflanzen wachsen, doch sind etwas schwierig in der Kultur und anfällig für Pilzbefall (Information von Thomas Rudolph). Nach meinem Eindruck lässt sich Bucephalandra auf lange Sicht einfacher submers als emers halten.
Gefährdung?
Die Insel Borneo ist bekannt für einzigartigen Artenreichtum wie für rasante Entwaldung. Darum sind dort natürlich Tiere und Pflanzen der Tropenwälder – auch die in Waldbächen wachsenden Rheophyten - generell gefährdet. Über konkrete Fälle von Schädigung oder Vernichtung von Cryptocoryne-Standorten durch Abholzung, Gewässerverschmutzung, Anlegen von Plantagen usw. oder auch durch Wegsammeln von Pflanzen für den Handel wurde schon öfter berichtet, aber anscheinend ist noch nichts Entsprechendes über Bucephalandra-Vorkommen veröffentlicht worden. Tomey (2004) erwähnt allerdings großflächige Land-Urbarmachung und Wasservergiftung durch Gold- und Diamantsuche in der Umgebung von Serimbu, wo Bucephalandra vorkommt. In der IUCN Red List-Datenbank (http://www.iucnredlist.org/search, abgerufen am 30.07.2013) ist die Gattung noch nicht erfasst worden. Offenbar gibt es für Bucephalandra-Arten auch noch keinen Schutzstatus. Wie man den Gefährdungsgrad von Lebewesen einschätzt, hängt auch davon ab, wie die Taxonomen sie einteilen. Falls einmal viele nur lokal verbreitete Bucephalandra-Arten wissenschaftlich beschrieben sein werden, wird man natürlich deren potenzielle Gefährdung höher einschätzen als wenn nur wenige, auf Borneo ziemlich weit verbreitete Arten unterschieden werden.
Wahrscheinlich wird die Nachfrage in Asien nach diesen sehr langsam wachsenden Pflanzen nach wie vor zum größten Teil durch Sammeln in der Natur gedeckt. Es wäre gut, wenn möglichst viele Bucephalandra-Varianten in Gärtnereien bzw. In-vitro-Labors vermehrt würden, damit die natürlichen Vorkommen geschont werden.
Zwar haben gesammelte Pflanzen eventuell wenigstens in Kultur eine Überlebenschance, wenn ihre Lebensräume sowieso zerstört werden. Aber viele Aspekte in der Biologie von Bucephalandra beginnen die Wissenschaftler gerade erst zu untersuchen und zu verstehen – Bestäubungsbiologie, Anpassung an spezielle Standortbedingungen, Phylogenie (Stammesgeschichte) und Verbreitungsgeschichte, genetische Variation, Artbildungsprozesse usw. –, und dies wird in Zukunft nur möglich sein, wenn viele der wunderschönen Bachbiotope mit Bucephalandra und anderen Rheophyten auf Borneo erhalten bleiben.



Dank
Für Informationen danke ich Josef Bogner, Peter C. Boyce, Tobias Coring, Marcel Dykierek, Thomas Rudolph und Tomasz Wastowski („vasteq“). Teck Song Wang danke ich für die Erlaubnis, Bilder von seinem Blog (http://illumbomb.blogspot.de/) zu nutzen. Vielen Dank auch an Piet van Wijngaarden, von dem ich die Bucephalandra erhielt, die Anfang der 2000er Jahre von Wim Tomey gesammelt worden war.
Literatur
- Bogner, J. (2004): Schismatoglottis roseospatha Bogner (Araceae). - Aqua Planta 29 (3): 86-87.
- Bogner, J. & Hay, A. (2000): Schismatoglottideae (Araceae) in Malesia II – Aridarum, Bucephalandra, Phymatarum and Piptospatha. - Telopea 9 (1): 179-222. (http://www.rbgsyd.nsw.gov.au/__data/assets/pdf_file/0007/72772/Tel9Bog179.pdf , abgerufen am 06.10.2011)
- Boyce, P.C. (1995): Bucephalandra motleyana. – Curtis’s Botanical Magazine 23 (3): 131-134. (http://www.aroid.org/gallery/boyce/Bucephalandra%20motleyana%20-%20Boyce%201995.pdf, abgerufen am 25.07.2013)
- Boyce, P.C., Bogner, J. & Mayo, S. (1995): Bucephalandra catherineae, a new species from Kalimantan. - Curtis's Botanical Magazine 12 (3): 150-153. (http://www.aroid.org/gallery/boyce/Bucephalandra%20catherineae%20-%20Boyce%2C%20Bogner%20%26%20Mayo%201995.pdf, abgerufen am 25.07.2013)
- Boyce, P.C. & Wong, S.Y. (2008a): A Decade of Schismatoglottis Species. - The IAS Newsletter 30 (3): 1-7. (http://www.aroid.org/society/nl30-03.pdf , abgerufen am 06.10.2011)
- Boyce, P.C. & Wong, S.Y. (2008b): Studies on Schismatoglottideae (Araceae) of Borneo VII: Schottarum and Bakoa, two new genera from Sarawak, Malaysian Borneo. - Botanical Studies 49: 393-404 (S. 394). (http://www.aroid.org/gallery/boyce/Studies%20on%20Schismatoglottideae%20%28Araceae%29%20of%20Borneo%20VII%20-%20Schottarum%20and%20Bakoa%20-%20%5BBotanical%20Studies%20%28Taipei%29%2049%2C%20393-404%5D%20-%20Boyce%20%26%20Wong%202008.pdf , abgerufen am 25.07.2013)
- Boyce, P.C. & Wong, S.Y. (2009): The Aroids of the West Sarawak Limestone. - IAS Newsletter 31 (2) (http://www.aroid.org/society/nl31-02/ , abgerufen am 16.02.2012)
- Boyce, P.C. & Wong, S.Y. (2012): Studies on Schismatoglottideae (Araceae) (Araceae) of Borneo XX: Beccari’s «La Più piccola delle Aracee» (Microcasia pygmaea) recollected and transferred to Bucephalandra Schott. - Webbia 67 (2): 139-146. (http://www.aroid.org/gallery/boyce/Schismatoglottideae%20of%20Borneo%20XX%20-%20Bucephalandra%20pygmaea%20-%20%5BWebbia%2067%282%29%20139-146%5D%20-%20Boyce%20%26%20Wong%202012.pdf , abgerufen am 25.07.2013)
- Kasselmann, C. (2010): Aquarienpflanzen. 3. Auflage. - DATZ Aquarienbuch, Ulmer Verlag, Stuttgart.
- Lo, Michael: Jungle Mike‘s secret gardens. (Blog) (http://junglemikey.blogspot.de/ , abgerufen 26.06.2013) Mayo, S.J., Bogner, J. & Boyce, P.C. (1997): The Genera of Araceae. – Royal Botanical Gardens, Kew, UK. (http://cate-araceae.myspecies.info/sites/cate-araceae.myspecies.info/files/Mayo%20et%20al%201997%20ARACEAE.pdf , abgerufen am 25.07.2013)
- Tomey, W.A. (2004): Bucephalandra motleyana Schott – ein Rheophyt als Aquarienpflanze? (Übersetzer: H.W.E. van Bruggen) - Aqua Planta 29 (3): 88-97.
- Van Steenis, C.G.G.J. (1981): Rheophytes of the World. – Sijthoff & Noordhoff, Alphen aan den Rijn.
- Wallach, B. (2007): Strömungsliebende Pflanzen. Rheophyten im Aquarium. - Aquarium live Oktober / November 2007.
- Wang, F. (in Zusammenarbeit mit Crimson Taiwan) (2012): „Mysteriöse“ Pflanzen von Borneo. - Amazonas Nr. 39, Januar/Februar 2012.
- Wang, T. S. („illumbomb“): (2011): Spathes of Bucephalandra vs. Aridarum vs. Bakoa. - illumbomb’s cryptocoryne blog (26.10.2011). (http://illumbomb.blogspot.com/2011/10/spathes-of-bucephalandra-vs-aridarum-vs.html, 20.11.2011)
- Wong, S.Y. & Boyce, P.C. (2013): The role of the interstice staminodes of Bucephalandra Schott (Araceae: Schismatoglottideae). – IAS Newsletter 35 (2): 11-12. (http://www.aroid.org/gallery/boyce/Role%20of%20interstice%20staminodes%20in%20Bucephalandra%20-%20%5BNewslett.%20Int.%20Aroid%20Soc.%20%2035%282%29%2011-12%5D%20-%20Wong%20%26%20Boyce%202013.pdf)
- Wong, S.Y., Boyce, P.C., bin Othman, A.S. & Pin, L.C. (2010): Molecular phylogeny of tribe Schismatoglottideae (Araceae) based on two plastid markers and recognition of a new tribe, Philonotieae, from the neotropics. - Taxon 59 (1): 117-124.